北京大学陈鹏团队联合多方力量首创“降解疫苗”新策略,研究成果于1月8日在《自然》在线发表。这项研究为攻克癌症免疫耐受难题提供了全新路径,点亮了癌症疫苗疗法的新希望。

肿瘤免疫疗法被誉为继手术、放化疗后的第三次抗癌革命,它通过松开免疫系统的“刹车”,使自身免疫细胞攻击恶性肿瘤。然而,许多癌症患者如非小细胞肺癌患者对免疫疗法无应答,原因是肿瘤细胞学会了“隐身术”,让免疫系统无法识别。
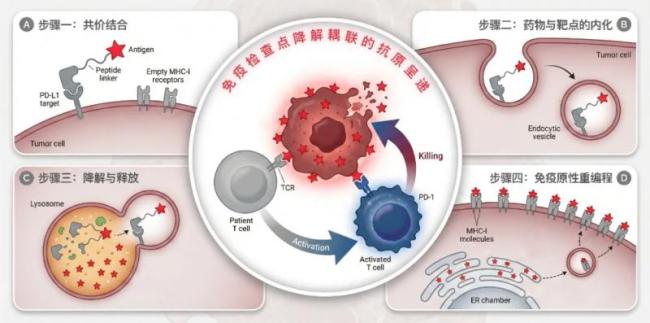
陈鹏团队利用蛋白靶向降解技术,开发出一种名为“瘤内疫苗嵌合体”(iVAC)的新型分子。这种分子量仅18kDa的小分子能够识别癌细胞,破坏免疫刹车,并呈递免疫情报。与传统疗法不同,iVAC无需依赖细胞表面特定的“门锁”即可进入细胞,高效完成两大任务:拆除癌细胞的PD-L1防御工事,松开免疫刹车;将精心挑选的病毒抗原片段加工呈递在细胞表面,给癌细胞贴上“敌人标签”。这一设计能唤醒强大的免疫军团,将“冷肿瘤”变为“热肿瘤”,实现精准歼灭。
这项突破源于思维与技术的双重跃迁,团队从膜蛋白靶向降解技术出发,融合癌症疫苗策略,跨化学合成、免疫学等多个领域,用微小的“功能分子”解决复杂的生命难题。目前,研究团队正积极推进临床转化,凭借药物分子的模块化设计,未来有望快速迭代个性化癌症疫苗,为癌症患者带来新的治疗希望。